28 Mar Anatomia di un evento stressante: dallo stress al sistema immunitario le basi scientifiche della psicosomatica
Articolo a cura di Fabio Sinibaldi e Sara Achilli.
Partiamo da un esempio concreto, che – almeno per analogia – può riguardare chiunque, dalle interrogazioni a scuola fino alle riunioni di lavoro:
facciamo parlare in pubblico una persona, dicendole che sarà valutata da un gruppo di esperti del comportamento
e ne analizziamo l’attivazione neurobiologica. Probabilmente qualcuno, solo leggendo questa descrizione e pensando di potersi trovare in una situazione analoga, avrà sentito un po’ di tensione farsi strada e si saranno innescate, anche se in forma leggera, alcune delle reazioni che stiamo per descrivere. Diversi studi (1) sono stati fatti proprio per studiare questi fenomeni nel dettaglio e tutti concordano sul fatto che avvengono due meccanismi, uno facilmente prevedibile, l’altro meno intuitivo.
Diversi studi (1) sono stati fatti proprio per studiare questi fenomeni nel dettaglio e tutti concordano sul fatto che avvengono due meccanismi, uno facilmente prevedibile, l’altro meno intuitivo.
Il primo riguarda l’attivazione della ben nota reazione di attacco-fuga (fight or fly) caratterizzata da aumento del battito cardiaco, pressione sanguina, cortisolo e catecolamine, oltre ad una serie di altri processi che ora non ci serve approfondire.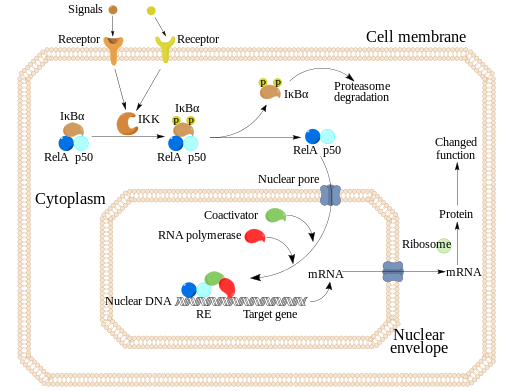 Il secondo meccanismo attiva rilevanti percorsi infiammatori nelle cellule sanguigne periferiche, inclusa l’attivazione del fattore nucleare di trascrizione (NF-kB), e porta a un marcato incremento delle citochine pro-infiammatorie in circolo, tra cui l’interleuchina-6 (IL-6).
Il secondo meccanismo attiva rilevanti percorsi infiammatori nelle cellule sanguigne periferiche, inclusa l’attivazione del fattore nucleare di trascrizione (NF-kB), e porta a un marcato incremento delle citochine pro-infiammatorie in circolo, tra cui l’interleuchina-6 (IL-6).
Correlazioni e Connessioni
Ma non è tutto. Ci sono anche significative correlazioni tra questa risposta infiammatoria e altri fattori. Ad esempio soggetti esposti a traumi infantili precoci (nel senso ampio di ACEs) mostrano una risposta infiammatoria maggiore a questo test di public-speaking rispetto agli altri soggetti. Guardando invece in termini prospettici, è stato osservato che le persone che mostrano una risposta infiammatoria più alta agli stress psicosociali presentano  un rischio significativamente più alto di sviluppare depressione nei mesi seguenti (2).
un rischio significativamente più alto di sviluppare depressione nei mesi seguenti (2).
Inoltre l’infiammazione favorisce l’iper-reattività emotiva in generale e altera i processi cognitivi quanto quelli motivazionali (3). Abbiamo fatto esempi di influenzamento reciproco in negativo, ma per fortuna esiste anche un rapporto di supporto vicendevole tra risposte emotive ed immunitarie.
Ad esempio le cellule T possono svolgere un ruolo protettivo rispetto a stress e depressione, favorendo il corretto funzionamento delle citochine, un cambiamento nella microglia e neurogenesi nell’ippocampo (4).
Allo stesso modo le citochine alla base delle risposte immunitarie possono avere un impatto rilevante rispetto alle monoamine serotonina, noradrenalina e dopamina alla base della regolazione dell’umore (5). Ma questi solo solo alcuni esempi di come questi percorsi possano creare circoli virtuosi che ad oggi non possono essere esclusi da nessun approccio terapeutico.  Tutto questi processi arrivano ad agire anche a livello epigenetico.
Tutto questi processi arrivano ad agire anche a livello epigenetico.
L’infiammazione può portare marcature epigenetiche in grado di amplificare le risposte depressive o ansiose di fronte a stress psicosociali. A riprova di questa correlazione bidirezionale tra stress e sistema immunitario a livello epigenetico c’è l’importante scoperta di come il trauma infantile sia associato con un’infiammazione aumentata attraverso il cambiamento epigenetico indotto da stress in FKBP5, un gene implicato nello sviluppo di depressione e ansia così come nella sensibilità ai gluco-corticoidi (6).
Siamo di fronte a una situazione che pone domande interessanti:
Come è possibile che uno stimolo (come il parlare in pubblico) privo di patogeni attivi il sistema immunitario?
Com’è possibile che l’infiammazione immunitaria favorisca ansia o depressione?
Questa comunicazione tra sistemi è frutto di un errore o qualcosa di più rilevante?
Dal momento che arriva a modificare l’espressione epigenetica c’è un significato adattativo ed evolutivo dietro a questi meccanismi?
La chiave di lettura integrata tra Evoluzionismo e PNEI
 Per rispondere a tutti questi interrogativi la prospettiva evoluzionista integrata con la lettura sistemica tipica della PsicoNeuroEndocrinoImmunologia ci viene in aiuto.
Per rispondere a tutti questi interrogativi la prospettiva evoluzionista integrata con la lettura sistemica tipica della PsicoNeuroEndocrinoImmunologia ci viene in aiuto.
Se torniamo indietro di parecchi anni è evidente che il sistema di attacco-fuga si attivava in determinate condizioni: quando la propria sopravvivenza era a rischio a causa delle attività di caccia, di essere cacciati da un predatore o di condizioni ambientali avverse. In ognuna di queste situazioni era altamente probabile riportare ferite, infezioni, entrare in contatto con i patogeni dell’aggressore o sostanze ambientali nocive.
Questo rende chiaro come il sistema immunitario dovesse necessariamente attivarsi insieme a quello di fight or fly. Dal punto evolutivo ha anche senso che tutti i sistemi si pre-attivassero solo alla percezione di un possibile rischio, in modo da preparare l’organismo in anticipo alla reazione. Questa prospettiva evoluzionista trova riscontri anche negli studi neuroscientifici e neurobiologici (7), che evidenziano il ruolo centrale del rapporto uomo-patogeni nello sviluppo dei cambiamenti evolutivi e dei processi adattamento.
Inoltre i meccanismi di comunicazione bi-direzionale tra sistema nervoso centrale, asse dello stress, sistema immunitario e sistema digerente appaiono frutto di un architettura evolutiva ben articolata e non possono essere spiegate solo dal caso (8).
Il problema al giorno d’oggi
Questi meccanismi sono evolutivi o, forse sarebbe meglio dire, erano evolutivi. Oggi infatti i rischi che attivano le nostre risposte di attacco o fuga non intaccano quasi mai la salute fisica, quindi non richiederebbero l’attivazione del sistema immunitario. Studiare per un esame, affrontare un colloquio di lavoro, arrabbiarsi quando siamo immersi nel traffico difficilmente ci portano a incontrare patogeni. Questo aspetto è cambiato, ma
i tempi dei processi evolutivi sono più lenti della nostra cultura
e, così, la risposta immunitaria si innesca anche se non necessaria. L’altro aspetto che è significativamente cambiato riguarda la frequenza. Pensate che l’uomo delle caverne vivesse peggio di noi? Forse aveva meno comfort, ma il suo asse dello stress si attivava poche volte al giorno o, addirittura, nell’arco una settimana. Pensate alla vita di una scimmia, quanto spesso pensate sia sotto stress durante la giornata? Ora pensate alla vita di una persona media nel mondo occidentale: si sveglia prima di quando vorrebbe, affronta il traffico, cerca parcheggio, discute al lavoro, sacrifica le proprie passioni o le relazioni sociali in nome del dovere o di altri vincoli, spesso mangia di fretta.  Certo, non sono pericoli di vita, ma sappiamo bene che l’amigdala, nel suo lavoro di distinzione tra stimoli salienti o meno, non fa molta differenza tra pericoli reali e immaginari, che – giustamente – considera vitale ogni invasione di campo, ogni spinta ad agire contro il proprio vantaggio adattativo, contro il risparmio di energia e contro la socialità (9).
Certo, non sono pericoli di vita, ma sappiamo bene che l’amigdala, nel suo lavoro di distinzione tra stimoli salienti o meno, non fa molta differenza tra pericoli reali e immaginari, che – giustamente – considera vitale ogni invasione di campo, ogni spinta ad agire contro il proprio vantaggio adattativo, contro il risparmio di energia e contro la socialità (9).
Cosa fare?
Alla luce di quanto abbiamo visto finora diventa necessario sviluppare un approccio integrato che tenga realmente conto di tutti i livelli di interazione tra mente, emozioni e sistema immunitario. Spesso si sente parlare di integrazione rimanendo sempre all’interno dello stesso ambito di discipline: diverse psicoterapie integrate tra loro, diverse medicine, diverse tecniche corporee, ecc. Questo approccio non mono-teoretico va benissimo, ma dovrebbe rappresentare la base della formazione di ogni professionista.
L’integrazione poi deve avvenire tra discipline differenti. Ovviamente uno psicologo non potrà mai fare un’operazione chirurgica e un ortopedico non sarà in grado di supportare un reduce di un trauma. Eppure tutti i professionisti possono – e devono – agire nel loro ambito tenendo in considerazione tutta la complessità di cui si stanno occupando.
Per fare un esempio concreto riferito a quanto abbiamo appena visto: l’infiammazione riduce sulla nostra capacità di rispondere alle ricompense e gratificazioni, riduce l’interesse verso le novità, mentre aumenta la sensibilità verso gli stimoli avversi. In termini applicativi vuol dire che sarà difficile aiutare le persone a “godersi la vita” o incoraggiarle a “vedere i propri successi” finché saranno in stato di infiammazione. Dall’alimentazione allo stile di vita, dalla soddisfazione dei propri bisogni ancestrali al modo di pensare, ci sono tanti modi per regolare i network immunitari e riportare i meccanismi infiammatori in fisiologia.
Di contro questo meccanismo distorto che porta a essere più sensibili agli stimoli avversi porta le persone a rinforzare le proprie credenze non solo a livello cognitivo continuando a trovare indizi negativi su cui ruminare, ma anche riattivando tutti i processi neurobiologici di stress e infiammazione di fronte ad ogni stimolo che ricorda o rievoca aspetti stressanti. Per questo è importante lavorare sulle abitudini sfruttandone i meccanismi neurobiologici su cui evolutivamente si basano (riconoscimento di indizi, attivazioni di routine, riduzione dei costi, aumento del piacere) e non con la sola forza di volontà.
L’altro sistema importante per potere regolare l’infiammazione è quello di agire sul suo legame con l’interocezione, alla base della capacità di autoregolarsi. Questo può essere fatto in diversi modi, ma il filo conduttore rimane sempre l’importanza dell’esperienza diretta, sensoriale e corporea.
Riferimenti bibliografici
1.a Pace, T. W. et al. Increased stress-induced inflammatory responses in male patients with major depression and increased early life stress. Am. J. Psychiatry 163, 1630–1633 (2006). 1.b Bierhaus, A. et al. A mechanism converting psychosocial stress into mononuclear cell activation. Proc. Natl Acad. Sci. USA 100, 1920–1925 (2003). 2. Aschbacher, K. et al. Maintenance of a positive outlook during acute stress protects against pro-inflammatory reactivity and future depressive symptoms. Brain Behav. Immun. 26, 346–352 (2012). 3. Beauchaine, T. (2001). Vagal tone, development, and Gray’s motivational theory: toward an integrated model of autonomic nervous system func- tioning in psychopathology. Dev. Psychopathol. 13, 183–214. doi: 10.1017/ S0954579401002012 4.a Brachman, R. A., Lehmann, M. L., Maric, D. & Herkenham, M. Lymphocytes from chronically stressed mice confer antidepressant-like effects to naive mice. J. Neurosci. 35, 1530–1538 (2015). 4.b Sandiego, C. M. et al. Imaging robust microglial activation after lipopolysaccharide administration in humans with PET. Proc. Natl Acad. Sci. USA 112, 12468–12473 (2015). 4.c Quan, N. & Banks, W. A. Brain-immune communication pathways. Brain Behav. Immun. 21, 727–735 (2007). 4.d D’Mello, C., Le, T. & Swain, M. G. Cerebral microglia recruit monocytes into the brain in response to tumor necrosis factor-α signaling during peripheral organ inflammation. J. Neurosci. 29, 2089–2102 (2009). 5.a Zhu, C. B. et al. Interleukin-1 receptor activation by systemic lipopolysaccharide induces behavioral despair linked to MAPK regulation of CNS serotonin transporters. Neuropsychopharmacology 35, 2510–2520 (2010). 5.b Neurauter, G. et al. Chronic immune stimulation correlates with reduced phenylalanine turnover. Curr. Drug Metab. 9, 622–627 (2008). 5.c Felger, J. C. et al. Tyrosine metabolism during interferon-α administration: association with fatigue and CSF dopamine concentrations. Brain Behav. Immun. 31, 153–160 (2013). 5.d Maes, M., Leonard, B. E., Myint, A. M., Kubera, M. & Verkerk, R. The new ‘5-HT’ hypothesis of depression: cell-mediated immune activation induces indoleamine 2,3-dioxygenase, which leads to lower plasma tryptophan and an increased synthesis of detrimental tryptophan catabolites (TRYCATs), both of which contribute to the onset of depression. Prog. Neuropsychopharmacol. Biol. Psychiatry 35, 702–721 (2011). 5.e Raison, C. L. et al. CSF concentrations of brain tryptophan and kynurenines during immune stimulation with IFN-α: relationship to CNS immune responses and depression. Mol. Psychiatry 15, 393–403 (2010). 6. Klengel, T. et al. Allele-specific FKBP5 DNA demethylation mediates gene-childhood trauma interactions. Nat. Neurosci. 16, 33–41 (2013). 7.a Choi, G. B., Dong, H. W., Murphy, A. J., Valenzuela, D. M., Yancopoulos, G. D., Swanson, L. W., and Anderson, D. J. (2005). Lhx6 delineates a path-way mediating innate reproductive behaviors from the amygdala to the hypothalamus. Neuron 46, 647–660. 7.b Swanson, L. W., and Petrovich, G. D. (1998). What is the amygdala? Trends Neurosci. 21, 323–331. 7.c LeDoux, J. E. (2012). Evolution of human emotion: a view through fear. Prog. Brain Res. 195, 431–442. 8.a Bottaccioli F., Psiconeuroendocrinoimmunologia, RED ED.,Milano, (2005). 8.b Mayer, E. A., Knight, R., Mazmanian, S. K., Cryan, J. F. & Tillisch, K. Gut microbes and the brain: paradigm shift in neuroscience. J. Neurosci. 34, 15490–15496 (2014). 8.c Porges, S. W. (1995). Orienting in a defensive world: mammalian modifications of our evolutionary heritage. A Polyvagal Theory. Psychophysiology 32, 301–318. doi: 10.1111/j.1469-8986.1995.tb01213.x 8.d Quan, N. & Banks, W. A. Brain-immune communication pathways. Brain Behav. Immun. 21, 727–735 (2007). 9.a Raison, C. L. & Miller, A. H. The evolutionary significance of depression in Pathogen Host Defense (PATHOS-D). Mol. Psychiatry 18, 15–37 (2013). 9b. Watson, P. J. & Andrews, P. W. Toward a revised evolutionary adaptationist analysis of depression: the social navigation hypothesis. J. Affect. Disord. 72, 1–14 (2002). 9.c Kinney, D. K. & Tanaka, M. An evolutionary hypothesis of depression and its symptoms, adaptive value, and risk factors. J. Nerv. Ment. Dis. 197, 561–567 (2009). 9.d Slavich, G. M. & Irwin, M. R. From stress to inflammation and major depressive disorder: a social signal transduction theory of depression. Psychol. Bull. 140, 774–815 (2014).